Tafinlar (Dabrafenib)
Tafinlar es el nombre comercial de dabrafenib, es un antineoplásico (inhibidor de tirosina quinasas) que impide el crecimiento de células tumorales.
¿Qué es y para qué se utiliza?
Este medicamento se utiliza en el tratamiento del melanoma (cáncer de piel) que no pueda operarse y presenta la mutación BRAF V600. Se puede utilizar en monoterapia o en combinación con trametinib (puede consultar la ficha de la combinación Tafinlar + Mekinist para más información sobre la terapia conjunta).
A temperatura ambiente, alejado de la humedad, el calor y la luz. Debe conservar las cápsulas en el envase original.
En el caso de que le sobre medicación, devuélvala lo antes posible al Servicio de Farmaciade su Hospital.
No utilice este medicamento después de la fecha de caducidad que aparece en la caja después de "CAD". La fecha de caducidad es el último día del mes que se indica.
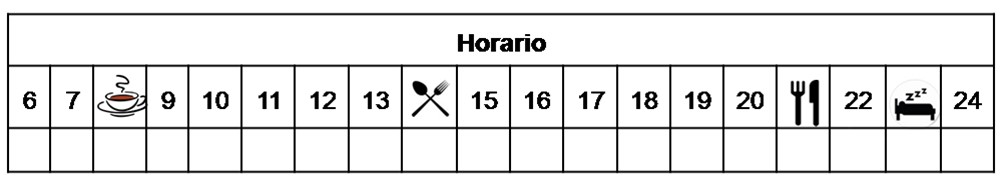
La dosis recomendada de dabrafenib (tanto se utilice solo o en combinación con trametinib) es 150 mg (es decir, 2 cápsulas de 75 mg) dos veces al día, cada 12 horas, sin alimentos (una hora antes, o dos horas después de las comidas).
No fraccione ni mastique las capsulas.
Uso en población pediátrica y adolescente
Existen estudios y ensayos clínicos que muestran que dabrafenib podría ser eficaz en niños para el tratamiento de tumores con la mutación BRAF V600, generalmente tumores cerebrales y de la médula espinal. Su médico y farmacéutico evaluarán cada caso particular y velarán por el uso seguro de trametinib en su hijo.
Su médico le indicará la dosis que debe tomar su hijo según su peso.
Las cápsulas deben tomarse enteras con un vaso de agua. Si su hijo tiene dificultad para tragar cápsulas enteras, consulte a su médico y/o farmacéutico sobre alternativas o recomendaciones de administración que ayuden a su hijo a tomar el dabrafenib de forma segura.
Además, debes leer y seguir cuidadosamente las instrucciones generales del manejo de citostáticos orales, que puedes consultar en el apartado CÓMO ADMINISTRAR LOS DIFERENTES TIPOS DE MEDICAMENTOS en el espacio de la escuela destinado a NIÑOS Y ADOLESCENTES.
¿Qué hacer si se olvida una dosis?
En caso de olvido, tome la dosis si quedan más de seis horas para la próxima dosis, y continúe su tratamiento con normalidad.
En caso de vómito, NO tome otra dosis ese día, y continúe su tratamiento con normalidad.
¿Qué efectos adversos pueden aparecer durante el tratamiento?
-
Muy frecuentes (1 de cada 10 personas):
-
Fiebre, dolor de cabeza, tos, diarrea, náuseas, vómitos, fatiga, dolor articular/muscular, cansancio, alteraciones electrolíticas y fragilidad/pérdida capilar.
-
-
Frecuentes (5 de cada 100 personas):
-
Reacciones dérmicas (síndrome mano-pie) y/o cardíacas.
-
-
Graves (1 de cada 1000 personas):
-
Carcinoma cutáneo, insuficiencia renal, uveítis y arritmias.
-
Si experimenta cualquier tipo de efecto adverso, consulte a su médico, farmacéutico o enfermero, incluso si se trata de posibles efectos adversos que no aparecen en esta hoja de información
Debe informar a su médico y farmacéutico de toda la medicación y productos naturales que tome. Algunos de los medicamentos que producen interacciones con dabrafenib son:
- Dasabuvir, deflazacor, grazoprevir, conivaptan, ranolazina, daclatasvir, rifampicina.
- Ketoconazol, claritromizina, gemfibrozilo, ritonavir, atazanavir, voriconazol, fenitoina, carbamazepina y fenobarbital.
- Anticonceptivos orales.
- Hierba de San Juan
Contraindicaciones:
Hipersensiblidad a dabrafenib o alguno de los excipientes.
Advertencias y precauciones:
Deberá avisar a su médico o farmacéutico:
- Si es alérgico a dabrafenib o alguno de sus excipientes.
- Historial de enfermedad renal, hepática, cardiaca, diabetes o deficiencia en la enzima Glucosa 6-P-DH.
- Antes de administrar cualquier vacuna consulte con su farmacéutico.
- Embarazo y lactancia.
Uso en poblaciones especiales:
- Puede que precise ajuste de la dosis si presenta efectos adversos graves.
Uso en embarazo o lactancia y efecto sobre la fertilidad:
- Dabrafenib puede causar daño fetal cuando se administra a mujeres embarazadas por lo que no debe utilizarse durante el embarazo.
- Se desconoce si dabrafenib puede pasar a leche materna y, por lo tanto, dañar a su bebé. Se debe valorar el beneficio/riesgo de suspender la lactancia o el tratamiento.
- En mujeres fértiles se recomienda utilizar métodos anticonceptivos eficaces durante y tras el tratamiento (al menos hasta 4 semanas después). Dabrafenib puede disminuir la eficacia de los anticonceptivos orales, por lo que en caso de utilizarlos se recomienda un método anticonceptivo adicional (contracepción de doble barrera).
- Dabrafenib puede alterar la fertilidad masculina de forma irreversible.
Conducción y uso de máquinas:
Dabrafenib afecta muy poco a la conducción o uso de máquinas. Si nota fatiga, alteraciones visuales u otras reacciones adversas que puedan afectar a la conducción o al uso de máquinas con seguridad, evite conducir o usar maquinaria mientras duren estos efectos secundarios.
Excipientes de declaración obligatoria:
- No contiene excipientes de declaración obligatoria.
Fecha de actualización:
08/12/2024
Fecha de próxima actualización:
30/09/2025
Autoría y revisión:
GEDEFO
Coautores:
GEFP